产品名称 | 产品编号 | 规格 | 储存 |
Quant TaqTM qPCR SYBR Green Master Mix Plus (No Rox) | SYT104S | 1 ml | -20℃避光 |
Quant TaqTM qPCR SYBR Green Master Mix Plus (No Rox) | SYT104 | 5×1 ml | -20℃避光 |
产品描述
Quant TaqTM qPCR SYBR Green Master Mix Plus (No Rox)是 2×实时定量 PCR 扩增的预混合溶液。Mix 中含有热启动 DNA Polymerase、taq抗体、SYBR Green I、dNTPs、Mg2+。使用时,仅需在扩增体系中加入模板和引物即可进行实时荧光定量 PCR,大大简化操作过程,降低污染几率。
本品采用的抗体法热启动DNA聚合酶,在预变性温度(95℃)加热30sec,Taq抗体失活,释放出Taq DNA Polymerase活性。抗体法热启动Taq酶可以有效抑制引物非特异性退火导致的扩增。同时,配方优化了有效抑制非特异性PCR扩增的因子和提升PCR反应扩增效率的因子,适合低浓度模板的扩增,使定量PCR可以在宽广的定量区域内获得良好的标准曲线。
适用机型
使用No ROX 仪器机型 | Bio-Rad CFX96™, CFX384™, iCycler iQ™, iQ™5, MyiQ™, Opticon®, Opticon 2, Chromo4™; MiniOpticon™, Cepheid SmartCycler®; Eppendorf Mastercycler® eprealplex, realplex 2s; Illumina Eco™ qPCR; Qiagen/Corbett Rotor-Gene® Q, Rotor-Gene® 3000, Rotor-Gene® 6000; Roche: LightCycler® 480, 96, Nano, 1.5/2.0**; Thermo Scientific PikoReal Cycler. |
使用Low ROX仪器机型 | Applied Biosystems: 7500, 7500 Fast, ViiA™7, QuantStudio 6 and 7 Flex System, QuantStudio 3 and 5; Agilent Stratagene: MX4000™, MX3005P™, MX3000P™. |
使用High ROX仪器机型 | Applied Biosystems: 5700, 7000, 7300, 7700, 7900, 7900HT, 7900HT Fast; StepOne™, StepOne Plus™. |
运输与保存方式
冰袋运输。-20℃避光储存,有效期 18 个月。
本品避免反复冻融。产品中含有荧光染料 SYBR Green I,保存或配制反应体系时需避免强光照射。
注意事项
1、. 解冻后Master Mix 可能出现絮状物质,4℃放置并上下颠倒混匀至溶液澄清,不影响试剂性能。
2. 、为了您的安全和健康,请穿实验服并佩戴一次性手套操作。
反应体系(推荐冰上配制)
组分 | 体积(μl) | 体积(μl) | 终浓度 |
Quant TaqTM qPCR SYBR Green Master Mix Plus (No Rox) | 25 | 10 | 1× |
Forward Primer (10 μM) | 1 | 0.4 | 0.2 μM |
Reverse Primer (10 μM) | 1 | 0.4 | 0.2 μM |
模板 DNA | X | X | - |
无菌超纯水 | to 50 | to 20 | - |
【注】: 使用前务必充分混匀,避免剧烈震荡产生过多气泡。
a)引物浓度:通常引物终浓度为 0.2 μM,也可以根据情况在 0.1-1.0 μM 之间进行调整。
b)模板浓度:如模板类型为未稀释 cDNA 原液,使用体积不应超过 qPCR 反应总体积的 1/10。
c)模板稀释:cDNA 原液建议 5-10 倍稀释,最佳模板加入量以扩增得到的 CT 值在 20-30 个循环为好。
d)反应体系:推荐使用 20μl 或 50μl,以保证目的基因扩增的有效性和重复性。
e)体系配制:请于超净工作台内配制,并使用无核酸酶残留的枪头、反应管;推荐使用带滤芯的枪头。避免交叉污染和气溶胶污染。
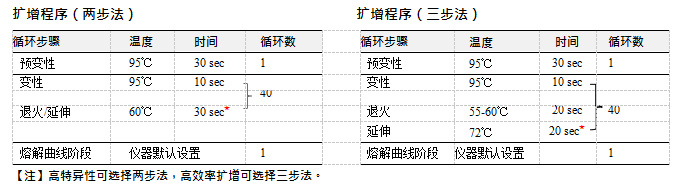
a)预变性时间:本反应条件适用于大多数基因扩增,如遇到含有复杂结构的基因可适当增长至3-5 min。
b)退火温度和时间:请根据引物和目的基因的长度进行调整。
c)荧光信号采集(★):请按照仪器使用说明书要求进行实验程序设置,几种常见仪器的时间设定如下:
30sec 以上:Applied Biosystems: StepOne, StepOne Plus, 7500 Fast;Roche Applied Science: LightCycler 480;Bio-Rad: CFX96
31sec 以上:Applied Biosystems: 7300
34sec 以上:Applied Biosystems: 7500
d)熔解曲线:通常情况下可以使用仪器默认程序。
结果分析
定量实验至少需要三个生物学重复。反应结束后需要确认扩增曲线及熔解曲线。
1) 扩增曲线:标准扩增曲线为S 型。
Ct 值落在 20-30 之间时,定量分析最准确;
Ct 值小于 10,需要将稀释模板后,重新进行实验;
Ct 值介于 30-35 之间时,需要提高模板浓度,或者增大反应体系的体积,以提高扩增效率,保证结果分析的准确性;
Ct 值大于 35 时,检测结果无法定量分析基因的表达量,但可用于定性分析。
2) 熔解曲线:
熔解曲线单峰,表明反应特异性好可以进行定量结果分析;若熔解曲线出现双峰或者多峰,则不能进行定量分析。熔解曲线出现双峰,需要通过 DNA 琼脂糖凝胶电泳判断非目标峰是引物二聚体还是非特异性扩增。
如果是引物二聚体,建议降低引物浓度,或者重新设计扩增效率高的引物。如果是非特异性扩增,请提高退火温度,或者重新设计更高特异性的引物。
引物设计指南
1、. 推荐引物长度 25 bp 左右。扩增产物长度 150 bp 为佳,可以在 100 bp-300 bp 内选择。
2、. 正向引物和反向引物的 Tm 值相差不宜超过 2℃。引物 Tm 值 60℃-65℃为佳。
3.、 引物碱基分布要均匀,避免出现连续的 4 个相同碱基,GC 含量控制在 50%左右。3’端最后一个碱基最好为 G 或 C。
4.、 引物内部或者正反两条引物间最好避免出现有 3 个碱基以上的互补序列。
5. 、引物特异性需要用 NCBI BLAST 程序进行核对。避免引物 3’端有 2 个碱基以上的非特异性互补。
6.、 设计完成的引物需要进行扩增效率的检测,只有具备相同扩增效率的引物才可用于定量比较分析。





